Hóilmiam, uimhir adamhach 67, meáchan adamhach 164.93032, ainm an eiliminte díorthaithe ó áit bhreithe an fhionnachtanaora.
Ábharhoilmiamsa screamh is é 0.000115%, agus tá sé ann i dteannta le cinn eileeilimintí cré neamhchoitiantai monaisít agus mianraí cré neamhchoitianta. Is é an t-iseatóp cobhsaí nádúrtha amháin ná holmiam 165.
Tá hoilmiam cobhsaí in aer tirim agus ocsaídíonn sé go tapa ag teochtaí arda;Ocsaíd holmiamis eol go bhfuil na hairíonna paraimaighnéadacha is láidre aige.
Is féidir comhdhúil holmiam a úsáid mar bhreiseán d’ábhair fheirimaighnéadacha nua; úsáidtear iaidíd holmiam chun lampaí halaigíde miotail a mhonarú –lampaí holmiam, agus úsáidtear léasair holmiam go forleathan sa réimse leighis freisin.

Ag Fionnachtain Stair
Aimsithe ag: JL Soret, PT Cleve
Aimsithe ó 1878 go 1879
Próiseas fionnachtana: aimsithe ag JL Soret sa bhliain 1878; aimsithe ag PT Cleve sa bhliain 1879
Tar éis do Mossander cré eirbiam a dheighilt agusteirbiamtalamh óitriamDomhan sa bhliain 1842, bhain go leor ceimiceoirí úsáid as anailís speictreach chun a aithint agus a chinneadh nach ocsaídí íona d’eilimint a bhí iontu, rud a spreag ceimiceoirí chun leanúint orthu ag scaradh. Tar éis ocsaíd iteirbiam agusocsaíd scaindiamÓ bhaoite ocsaídithe, scar Cliff dhá ocsaíd eiliminteach nua sa bhliain 1879. Tugtar Holmium ar cheann acu chun comóradh a dhéanamh ar áit bhreithe Cliff, an t-ainm Laidine ársa Holmia i Stócólm, an tSualainn, leis an tsiombail eiliminteach Ho. Sa bhliain 1886, scar Bouvabadrand eilimint eile ó holmiam, ach coinníodh ainm holmiam. Le fionnachtain holmiam agus eilimintí cré-annamha eile, tá céim eile den tríú fionnachtain ar eilimintí cré-annamha críochnaithe.
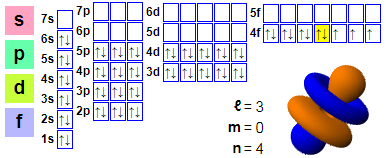
Leagan amach leictreonach:
Leagan amach leictreonach:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f11
Is miotal é a fhéadann, cosúil le disprósiam, neodróin a tháirgtear trí eamhnú núicléach a ionsú.
In imoibreoir núicléach, ar thaobh amháin, déantar dóchán leanúnach, agus ar an taobh eile, rialaítear luas an imoibrithe slabhra.
Cur Síos ar an Eilimint: Is é 6.02 volta leictreon an chéad fhuinneamh ianúcháin. Tá snasta miotalach air. Is féidir leis imoibriú go mall le huisce agus tuaslagadh in aigéid chaolaithe. Tá an salann buí. Tá an ocsaíd Ho2O2 glas éadrom. Tuaslaig in aigéid mhianracha chun salainn bhuí ian trífhiúsacha a tháirgeadh.
Foinse eiliminte: ullmhaithe trí fhluairíd hoilmiam HoF3 · 2H2O a laghdú le cailciam.
Miotal
Is miotal airgid-bhán é hoilmiam le huigeacht bhog agus insínteacht; pointe leá 1474 °C, fiuchphointe 2695 °C, dlús 8.7947 g/cm² hoilmiam.
Tá hoilmiam cobhsaí in aer tirim agus ocsaídíonn sé go tapa ag teochtaí arda; is eol go bhfuil na hairíonna paraimaighnéadacha is láidre ag ocsaíd hoilmiam.
Comhdhúile a fháil ar féidir iad a úsáid mar bhreiseáin d’ábhair fheirimaighnéadacha nua; iaidíd holmiam a úsáidtear i monarú lampaí halaíde miotail – lampaí holmiam
Feidhmchlár
(1) Mar bhreiseán do lampaí halaíde miotail, is cineál lampa urscaoilte gáis iad lampaí halaíde miotail atá forbartha ar bhonn lampaí mearcair ardbhrú, arb iad is sainairíonna an bolgán a líonadh le halaídí cré-annamh éagsúla. Faoi láthair, is é iaidíd cré-annamh an phríomhúsáid, a astaíonn dathanna speictreacha éagsúla le linn urscaoilte gáis. Is é iaidíd halaíme an tsubstaint oibre a úsáidtear i lampaí holmiam, ar féidir leis tiúchan ard d'adaimh miotail a bhaint amach sa chrios stua, rud a fheabhsaíonn éifeachtúlacht radaíochta go mór.
(2) Is féidir holmiam a úsáid mar bhreiseán le haghaidh iarainn itriam nó gairnéad alúmanaim itriam.
(3) Is féidir le gairnéad alúmanaim itriam dópáilte le Ho:YAG léasar 2 μ M a astú, fíochán daonna ar 2 μ. Tá ráta ionsúcháin léasair m ard, beagnach trí ord méide níos airde ná ráta ionsúcháin Hd:YAG. Mar sin, agus léasar Ho:YAG á úsáid le haghaidh máinliachta leighis, ní hamháin gur féidir feabhas a chur ar éifeachtúlacht agus cruinneas na máinliachta, ach is féidir an limistéar damáiste teirmeach a laghdú go méid níos lú freisin. Is féidir leis an bhíoma saor a ghintear le criostail holmiam saill a dhíchur gan teas iomarcach a ghiniúint, rud a laghdaíonn damáiste teirmeach do fhíocháin shláintiúla. Tuairiscítear gur féidir le cóireáil léasair holmiam le haghaidh glaucoma sna Stáit Aontaithe pian othar atá ag dul faoi obráid a laghdú. Tá leibhéal criostail léasair m sa tSín 2 μ sroichte ag an leibhéal idirnáisiúnta, agus ba cheart iarrachtaí a dhéanamh an cineál seo criostail léasair a fhorbairt agus a tháirgeadh.
(4) Sa chóimhiotal maighnéadastríochnach Terfenol D, is féidir méid beag holmiam a chur leis freisin chun an réimse seachtrach atá riachtanach le haghaidh maighnéadú sáithiúcháin an chóimhiotail a laghdú.
(5) Is féidir le húsáid snáithín dópáilte le holmiam feistí cumarsáide optúla amhail léasair snáithíní, aimplitheoirí snáithíní, agus braiteoirí snáithíní a dhéanamh, a mbeidh ról níos tábhachtaí acu i bhforbairt thapa na cumarsáide snáithíní optúla inniu.
(6) Teicneolaíocht lithotripsy léasair holmiam: Tá lithotripsy léasair holmiam leighis oiriúnach do chlocha crua duáin, clocha úiréadair, agus clocha lamhnáin nach féidir a bhriseadh le lithotripsy tonn turraing eachtarchorpach. Agus lithotripsy léasair holmiam leighis á úsáid, úsáidtear snáithín caol an léasair holmiam leighis chun an lamhnán, an t-úiréadar, agus na clocha duáin a bhaint amach go díreach tríd an úiréadra agus an t-úiréadar trí chisteascóp agus úiréadrascóp. Ansin, déanann saineolaithe úireolaíochta an léasar holmiam a ionramháil chun na clocha a bhriseadh. Is é buntáiste an mhodha cóireála léasair holmiam seo ná gur féidir leis clocha úiréadair, clocha lamhnáin, agus formhór mór na gcloch duáin a réiteach. Is é an míbhuntáiste ná go bhféadfadh méid beag clocha iarmharacha a bheith ann i gcás roinnt clocha sna calaí duánacha uachtaracha agus íochtaracha mar gheall ar neamhábaltacht an tsnáithín léasair holmiam atá ag dul isteach ón úiréadar teacht ar shuíomh na cloiche.
Am an phoist: 16 Lúnasa 2023