Scaidiam, le siombail na dúile Sc agus uimhir adamhach 21, tá sé intuaslagtha go héasca in uisce, is féidir leis idirghníomhú le huisce te, agus dorchaíonn sé go héasca san aer. Is é +3 a phríomh-vails. Is minic a mheasctar é le gadolinium, eirbiam, agus dúile eile, le toradh íseal agus cion de thart ar 0.0005% sa screamh. Úsáidtear scaindiam go minic chun gloine speisialta agus cóimhiotail ardteochta éadroma a dhéanamh.
Faoi láthair, níl ach 2 mhilliún tonna de chúlchistí scaindiam cruthaithe ar domhan, agus tá 90~95% díobh sin i mianta báicsíte, fosfaraíte agus tíotáiniam iarainn, agus cuid bheag díobh i mianta úráiniam, tóiriam, tungstain agus cré-annamh, a dháiltear den chuid is mó sa Rúis, sa tSín, sa Táidsíceastáin, i Madagascar, san Iorua agus i dtíortha eile. Tá acmhainní scaindiam an-saibhir sa tSín, agus tá cúlchistí mianraí ollmhóra a bhaineann le scaindiam aici. De réir staitisticí neamhiomlána, tá thart ar 600,000 tonna de chúlchistí scaindiam sa tSín, agus tá siad sin i dtaiscí báicsíte agus fosfaraíte, i dtaiscí tungstain porfaire agus grianchloiche i nDeisceart na Síne, i dtaiscí cré-annamh i nDeisceart na Síne, i dtaiscí iarainn-annamh Bayan Obo i Lár na Mongóile, agus i dtaiscí maighnéadíte tíotáiniam vanaidiam Panzhihua i Sichuan.
Mar gheall ar ghanntanas scaindiam, tá praghas an scaindiam an-ard freisin, agus ag a bhuaicphointe, bhí praghas an scaindiam boilscithe go 10 n-uaire phraghas an óir. Cé gur thit praghas an scaindiam, tá sé fós ceithre huaire praghas an óir!
Ag Fionnachtain Stair
Sa bhliain 1869, thug Mendeleev faoi deara bearna i mais adamhach idir cailciam (40) agus tíotáiniam (48), agus thuar sé go raibh dúil mais adamhach idirmheánach gan aimsiú anseo freisin. Thuar sé gurb é X ₂ O Å a ocsaíd. Fuair Lars Frederik Nilson ó Ollscoil Uppsala sa tSualainn scaindiam amach sa bhliain 1879. Bhain sé é as an mianach óir dubh neamhchoitianta, méine casta ina bhfuil 8 gcineál ocsaídí miotail. Bhain sé é amachOcsaíd eirbiam(III)ó mhianach óir dubh neamhchoitianta, agus a fhaightearOcsaíd iteirbiam(III)ón ocsaíd seo, agus tá ocsaíd eile de dhúil níos éadroime ann, a léiríonn a speictream gur miotal anaithnid é. Seo an miotal a thuar Mendeleev, a bhfuil a ocsaídSc₂O₃Rinneadh an miotal scaindiam féin a tháirgeadh óClóiríd scaindiamtrí leá leictrealaíoch i 1937.
Mendeleev
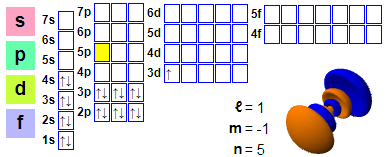
Cumraíocht leictreon
Cumraíocht leictreon: 1s² 2s² 2p6 3s² 3p6 4s² 3d1
Is miotal trasdultach bog, airgid-bán é scaindiam a bhfuil pointe leá de 1541 ℃ agus fiuchphointe de 2831 ℃ aige.
Ar feadh tréimhse fada tar éis a fhionnachtana, níor léiríodh úsáid scaindiam mar gheall ar a dheacracht táirgthe. Le feabhas méadaitheach ar mhodhanna deighilte dúile cré-annamha, tá sreabhadh próisis aibí ann anois chun comhdhúile scaindiam a íonú. Ós rud é go bhfuil scaindiam níos lú alcaileach ná itriam agus Lanthanide, is é an hiodrocsaíd an ceann is laige, mar sin déanfar an mianra measctha dúile cré-annamha ina bhfuil scaindiam a dheighilt ón dúil cré-annamh tríd an modh “deascadh céimneach” nuair a dhéantar hiodrocsaíd Scaindiam(III) a chóireáil le hamóinia tar éis é a aistriú isteach i dtuaslagán. Is é an modh eile ná níotráit scaindiam a dheighilt trí dhianscaoileadh polach níotráite. Ós rud é gurb é níotráit scaindiam an ceann is fusa a dhíghrádú, is féidir scaindiam a dheighilt. Ina theannta sin, is foinse thábhachtach scaindiam freisin an aisghabháil chuimsitheach scaindiam a ghabhann leis ó úráiniam, tóiriam, tungstain, stáin agus taiscí mianraí eile.
Tar éis comhdhúil scaindiam íon a fháil, déantar é a thiontú ina ScCl₃Å₃ agus comhleáítear é le KCl agus LiCl. Úsáidtear an since leáite mar chatóid le haghaidh leictrealú, rud a fhágann go ndéanann scaindiam deascadh ar an leictreoid since. Ansin, galaítear an since chun scaindiam miotalach a fháil. Is miotal airgid-bán éadrom é seo a bhfuil airíonna ceimiceacha an-ghníomhacha aige, ar féidir leis imoibriú le huisce te chun gás hidrigine a ghiniúint. Mar sin, séalaítear an scaindiam miotalach a fheiceann tú sa phictiúr i mbotella agus cosnaítear é le gás argóin, nó foirmeoidh scaindiam ciseal ocsaíde buí dorcha nó liath go tapa, ag cailleadh a snasta miotalach lonrach.
Feidhmchláir
Tionscal soilsithe
Tá úsáidí scaindiam dírithe i dtreonna an-gheala, agus ní áibhéil é Mac an tSolais a thabhairt air. Tugtar lampa sóidiam scaindiam ar an gcéad arm draíochta de scaindiam, ar féidir é a úsáid chun solas a thabhairt do na mílte teaghlach. Is solas leictreach halaíd miotail é seo: líontar an bolgán le hiaidíd sóidiam agus tríiaidíd scaindiam, agus cuirtear scragall scaindiam agus sóidiam leis ag an am céanna. Le linn urscaoilte ardvoltais, astaíonn iain scaindiam agus iain sóidiam solas dá dtonnfhaid astaíochta tréithiúla faoi seach. Is iad línte speictreacha sóidiam 589.0 agus 589.6 nm, dhá sholas buí cáiliúla, agus is iad línte speictreacha scaindiam 361.3 ~ 424.7 nm, sraith d'astaíochtaí solais gar-ultraivialait agus gorm. Toisc go gcomhlánaíonn siad a chéile, is solas bán an dath solais foriomlán a tháirgtear. Is é an fáth go bhfuil tréithe éifeachtúlachta lonrúla ard, dea-dath solais, coigilt cumhachta, saolré seirbhíse fada, agus cumas láidir briseadh ceo ag lampaí sóidiam go bhfuil siad in úsáid go forleathan le haghaidh ceamaraí teilifíse, cearnóga, ionaid spóirt, agus soilsiú bóthair, agus tugtar foinsí solais tríú glúin orthu. Sa tSín, tá an cineál seo lampa á chur chun cinn de réir a chéile mar theicneolaíocht nua, agus i roinnt tíortha forbartha, úsáideadh an cineál seo lampa go forleathan chomh luath leis na 1980idí luatha.
Is iad cealla fótavoltacha gréine an dara arm draíochta atá ag scaindiam, ar féidir leo an solas atá scaipthe ar an talamh a bhailiú agus é a thiontú ina leictreachas chun an tsochaí dhaonna a thiomáint. Is é scaindiam an miotal bacainn is fearr i gcealla gréine sileacain leathsheoltóra inslitheoirí miotail agus i gcealla gréine.
Is é foinse gha γ A a thríú arm draíochta, is féidir leis an arm draíochta seo lonrú go geal leis féin, ach ní féidir leis an tsúil nocht an cineál seo solais a fháil, is sreabhadh fótóin ard-fhuinnimh é. De ghnáth, bainimid 45Sc as mianraí, arb iad na hiseatóip nádúrtha amháin de scaindiam iad. Tá 21 prótón agus 24 neodrón i ngach núicléas 45Sc. Is féidir 46Sc, iseatóp radaighníomhach saorga, a úsáid mar fhoinsí radaíochta γ nó is féidir adaimh rianaithe a úsáid freisin le haghaidh radaiteiripe meall urchóideacha. Tá feidhmeanna ann freisin cosúil le léasar itriam, galliam, scaindiam, gairnéad,Fluairíd scaindiamSnáithín optúil infridhearg gloine, agus feadán gathanna catóide brataithe le scaindiam ar an teilifís. Is cosúil go bhfuil gile ag baint le scaindiam.
Tionscal cóimhiotail
Úsáidtear scaindiam ina fhoirm eiliminteach go forleathan chun cóimhiotail alúmanaim a dhópáil. Chomh fada agus a chuirtear cúpla míleú de scaindiam le halúmanam, cruthófar céim nua Al3Sc, a imreoidh ról meiteamorfachtach i gcóimhiotal alúmanaim agus a athróidh struchtúr agus airíonna an chóimhiotail go suntasach. Is féidir le 0.2% ~ 0.4% Sc a chur leis (atá an-chosúil leis an gcion a chuirtear salann le glasraí friochta sa bhaile, níl ach beagán ag teastáil) teocht athchriostalaithe an chóimhiotail a mhéadú faoi 150-200 ℃, agus neart ardteochta, cobhsaíocht struchtúrach, feidhmíocht táthúcháin, agus friotaíocht creimeadh a fheabhsú go suntasach. Is féidir leis an feiniméan briosctha a sheachaint freisin a tharlaíonn go héasca le linn oibre fadtéarmach ag teochtaí arda. Tá ionchais forbartha an-tarraingteacha ag cóimhiotal alúmanaim ard-neart agus ard-diana, cóimhiotal alúmanaim táthaithe ard-neart nua atá frithsheasmhach in aghaidh creimeadh, cóimhiotal alúmanaim ard-teocht nua, cóimhiotal alúmanaim ard-neart atá frithsheasmhach in aghaidh ionradaíochta neodrón, etc., san aeraspás, san eitlíocht, i longa, in imoibreoirí núicléacha, i bhfeithiclí éadroma agus i dtraenacha ardluais.
Is modhnóir den scoth é scaindiam le haghaidh iarainn freisin, agus is féidir le méid beag scaindiam neart agus cruas an iarainn teilgthe a fheabhsú go suntasach. Ina theannta sin, is féidir scaindiam a úsáid mar bhreiseán le haghaidh cóimhiotail tungstain agus cróimiam ardteochta. Ar ndóigh, chomh maith le héadaí bainise a dhéanamh do dhaoine eile, tá pointe leá ard ag scaindiam agus tá a dhlús cosúil le alúmanam, agus úsáidtear é freisin i gcóimhiotail éadroma le pointe leá ard amhail cóimhiotal tíotáiniam scaindiam agus cóimhiotal maignéisiam scaindiam. Mar sin féin, mar gheall ar a phraghas ard, ní úsáidtear é go ginearálta ach i dtionscail déantúsaíochta ardleibhéil amhail tointeálaithe spáis agus roicéid.
Ábhar ceirmeach
Is substaint aonair é scaindiam, a úsáidtear i gcóimhiotail de ghnáth, agus tá ról tábhachtach ag a ocsaídí in ábhair cheirmeacha ar bhealach cosúil. Tá airí uathúil ag an ábhar ceirmeach siorcóinia teitreagónach, ar féidir é a úsáid mar ábhar leictreoid do chealla breosla ocsaíde soladaí, ina méadaíonn seoltacht an leictrilít seo de réir mar a mhéadaíonn an teocht agus tiúchan ocsaigine sa timpeallacht. Mar sin féin, ní féidir le struchtúr criostail an ábhair cheirmigh seo féin maireachtáil go cobhsaí agus níl aon luach tionsclaíoch aige; Tá sé riachtanach roinnt substaintí a dhópáil ar féidir leo an struchtúr seo a shocrú chun a airíonna bunaidh a choinneáil. Tá 6 ~ 10% d'ocsaíd scaindiam a chur leis cosúil le struchtúr coincréite, ionas gur féidir siorcóinia a chobhsú ar laitís chearnógach.
Tá ábhair cheirmeacha innealtóireachta ann freisin amhail níotráit sileacain ard-neart agus atá frithsheasmhach in aghaidh ardteochta mar dhlúthaitheoirí agus cobhsaitheoirí.
Mar dhlúthaitheoir,Ocsaíd scaindiamIs féidir leis céim teasfhulangach Sc2Si2O7 a fhoirmiú ag imeall na gcáithníní míne, rud a laghdaíonn dífhoirmiú ardteochta criadóireachta innealtóireachta. I gcomparáid le hocsaídí eile, is féidir leis airíonna meicniúla ardteochta níotráite sileacain a fheabhsú níos fearr.
Ceimic chatalaíoch
San innealtóireacht cheimiceach, is minic a úsáidtear scaindiam mar chatalaíoch, agus is féidir Sc2O3 a úsáid le haghaidh díhiodráitithe agus dí-ocsaídiúcháin eatánóil nó isopropanóil, dianscaoileadh aigéid aicéitigh, agus táirgeadh eitiléine ó CO agus H2. Is catalaíoch tábhachtach é an catalaíoch Pt Al ina bhfuil Sc2O3 freisin le haghaidh próisis íonúcháin agus scagtha hidriginithe ola throm sa tionscal peitriceimiceach. In imoibrithe scoilteadh catalaíoch amhail Cumene, tá gníomhaíocht chatalaíoch zeolite Sc-Y 1000 uair níos airde ná gníomhaíocht chatalaíoch sileacáit alúmanaim; I gcomparáid le roinnt catalaíoch traidisiúnta, beidh ionchais forbartha catalaíoch scaindiam an-gheal.
Tionscal fuinnimh núicléiche
Is féidir claochlú laitíse, méadú ar thoirt, agus scoilteadh de bharr tiontú UO2 go U3O8 a sheachaint trí mhéid beag Sc2O3 a chur le UO2 i mbreosla núicléach imoibritheora ardteochta.
Ceall breosla
Ar an gcaoi chéanna, méadóidh 2.5% go 25% scaindiam a chur le cadhnraí nicil-alcaile a saol seirbhíse.
Pórú talmhaíochta
Sa talmhaíocht, is féidir síolta ar nós arbhar, biatas, piseanna, cruithneachta agus lus na gréine a chóireáil le sulfáit scandiam (is gnách go mbíonn an tiúchan 10-3 ~ 10-8 mol / L, beidh difríocht ag plandaí difriúla), agus baineadh amach an éifeacht iarbhír maidir le péacadh a chur chun cinn. Tar éis 8 n-uaire an chloig, mhéadaigh meáchan tirim fréamhacha agus bachlóga 37% agus 78% faoi seach i gcomparáid le síológa, ach tá an mheicníocht fós faoi staidéar.
Ó aird Nielsen ar fhiach sonraí maise adamhach go dtí an lá atá inniu ann, níor tháinig scaindiam isteach i radharc daoine ach le céad nó fiche bliain, ach tá sé beagnach ina shuí ar an mbinse ar feadh céad bliain. Níor thug sé beocht dó go dtí forbairt bhríomhar na heolaíochta ábhar ag deireadh na haoise seo caite. Sa lá atá inniu ann, tá dúile cré neamhchoitianta, lena n-áirítear scaindiam, ina réaltaí te san eolaíocht ábhar, ag imirt róil atá ag athrú i gcónaí i na mílte córas, ag tabhairt níos mó áise dár saol gach lá, agus ag cruthú luach eacnamaíoch atá níos deacra fós a thomhas.
Am an phoist: 29 Meitheamh 2023